Mūsdienu medicīnas jomā antibiotikas ir pierādījušas sevi kā vienu no nozīmīgākajiem sasniegumiem, kas ievērojami samazina ar mikrobiālām infekcijām saistīto saslimstību un mirstību. To spēja mainīt bakteriālu infekciju klīniskos rezultātus ir pagarinājusi neskaitāmu pacientu paredzamo dzīves ilgumu. Antibiotikas ir kritiski svarīgas sarežģītās medicīniskās procedūrās, tostarp operācijās, implantu ievietošanā, transplantācijās un ķīmijterapijā. Tomēr antibiotikām rezistentu patogēnu parādīšanās rada arvien lielākas bažas, laika gaitā samazinot šo zāļu efektivitāti. Antibiotiku rezistences gadījumi ir dokumentēti visās antibiotiku kategorijās, jo notiek mikrobu mutācijas. Antimikrobiālo zāļu radītais selekcijas spiediens ir veicinājis rezistentu celmu pieaugumu, radot ievērojamas problēmas globālajai veselībai.
Lai cīnītos pret aktuālo pretmikrobu rezistences problēmu, ir svarīgi īstenot efektīvu infekciju kontroles politiku, kas ierobežo rezistentu patogēnu izplatību, kā arī samazina antibiotiku lietošanu. Turklāt ir steidzami nepieciešamas alternatīvas ārstēšanas metodes. Šajā kontekstā daudzsološa metode ir parādījusies hiperbariskā skābekļa terapija (HBOT), kas ietver 100% skābekļa ieelpošanu noteiktā spiediena līmenī noteiktu laika periodu. Pozicionēta kā primāra vai papildinoša infekciju ārstēšanas metode, HBOT var sniegt jaunu cerību akūtu infekciju ārstēšanā, ko izraisa pret antibiotikām rezistenti patogēni.
Šī terapija arvien vairāk tiek pielietota kā primārā vai alternatīva ārstēšanas metode dažādiem stāvokļiem, tostarp iekaisumam, saindēšanās ar oglekļa monoksīdu, hroniskām brūcēm, išēmiskām slimībām un infekcijām. HBOT klīniskais pielietojums infekciju ārstēšanā ir plašs, sniedzot nenovērtējamas priekšrocības pacientiem.

Hiperbariskās skābekļa terapijas klīniskais pielietojums infekcijas gadījumā
Pašreizējie pierādījumi pārliecinoši apstiprina HBOT lietošanu gan kā patstāvīgu, gan papildinošu ārstēšanu, sniedzot ievērojamu labumu inficētiem pacientiem. HBOT laikā arteriālo asiņu skābekļa spiediens var paaugstināties līdz 2000 mmHg, un iegūtais augstais skābekļa-audu spiediena gradients var paaugstināt skābekļa līmeni audos līdz 500 mmHg. Šāda iedarbība ir īpaši vērtīga, lai veicinātu išēmiskā vidē novērotu iekaisuma reakciju un mikrocirkulācijas traucējumu dzīšanu, kā arī kompartmenta sindroma ārstēšanā.
HBOT var ietekmēt arī stāvokļus, kas ir atkarīgi no imūnsistēmas. Pētījumi liecina, ka HBOT var nomākt autoimūnus sindromus un antigēnu izraisītas imūnās atbildes, palīdzot uzturēt transplantāta toleranci, samazinot limfocītu un leikocītu cirkulāciju, vienlaikus modulējot imūnās atbildes. Turklāt HBOTatbalsta dziedināšanuhronisku ādas bojājumu gadījumā, stimulējot angioģenēzi, kas ir kritiski svarīgs process uzlabotai atveseļošanai. Šī terapija veicina arī kolagēna matricas veidošanos, kas ir būtiska brūču dzīšanas fāze.
Īpaša uzmanība jāpievērš noteiktām infekcijām, īpaši dziļām un grūti ārstējamām infekcijām, piemēram, nekrotizējošam fascītam, osteomielītam, hroniskām mīksto audu infekcijām un infekciozam endokardītam. Viens no visbiežāk sastopamajiem HBOT klīniskajiem pielietojumiem ir ādas un mīksto audu infekcijas un osteomielīts, kas saistīts ar zemu skābekļa līmeni un ko bieži izraisa anaerobās vai rezistentās baktērijas.
1. Diabētiskās pēdas infekcijas
Diabētiskā pēdaČūlas ir izplatīta komplikācija diabēta pacientu vidū, kas skar līdz pat 25% šīs populācijas. Šajās čūlās bieži rodas infekcijas (40–80% gadījumu), kas izraisa paaugstinātu saslimstību un mirstību. Diabētiskās pēdas infekcijas (DFI) parasti sastāv no polimikrobiālām infekcijām, kurās tiek identificēti dažādi anaerobi baktēriju patogēni. Dažādi faktori, tostarp fibroblastu funkcijas defekti, kolagēna veidošanās problēmas, šūnu imūnsistēmas mehānismi un fagocītu funkcija, var kavēt brūču dzīšanu diabēta pacientiem. Vairākos pētījumos ir konstatēts, ka traucēta ādas apgāde ar skābekli ir spēcīgs riska faktors amputācijām, kas saistītas ar DFI.
Kā viena no pašreizējām DFI ārstēšanas iespējāmIr ziņots, ka HBOT ievērojami uzlabo diabētiskās pēdas čūlu dzīšanas rādītājus, tādējādi samazinot amputāciju un sarežģītu ķirurģisku iejaukšanos nepieciešamību. Tas ne tikai samazina nepieciešamību pēc resursietilpīgām procedūrām, piemēram, lēveru operācijām un ādas transplantācijas, bet arī piedāvā zemākas izmaksas un minimālas blakusparādības salīdzinājumā ar ķirurģiskām iespējām. Čena un līdzautoru pētījums parādīja, ka vairāk nekā 10 HBOT sesijas uzlaboja brūču dzīšanas rādītājus diabēta pacientiem par 78,3 %.
2. Nekrotizējošas mīksto audu infekcijas
Nekrotizējošas mīksto audu infekcijas (NSTI) bieži ir polimikrobiālas, parasti rodas aerobisko un anaerobo baktēriju patogēnu kombinācijas rezultātā, un tās bieži ir saistītas ar gāzu veidošanos. Lai gan NSTI ir relatīvi reti sastopamas, tām ir augsts mirstības līmenis to straujās progresēšanas dēļ. Savlaicīga un atbilstoša diagnostika un ārstēšana ir būtiska labvēlīgu rezultātu sasniegšanai, un HBOT ir ieteikta kā papildmetode NSTI ārstēšanai. Lai gan joprojām pastāv strīdi par HBOT lietošanu NSTI gadījumā prospektīvu kontrolētu pētījumu trūkuma dēļ,Pierādījumi liecina, ka tas varētu būt saistīts ar uzlabotu izdzīvošanas rādītāju un orgānu saglabāšanu pacientiem ar neinficētām infekcijām (NSTI).Retrospektīvā pētījumā tika konstatēta ievērojama mirstības līmeņa samazināšanās pacientiem ar neinficētu infekciju (NSTI), kuri saņem HBOT.
1.3 Ķirurģiskās zonas infekcijas
SSI var klasificēt, pamatojoties uz infekcijas anatomisko atrašanās vietu, un tās var rasties no dažādiem patogēniem, tostarp gan aerobām, gan anaerobām baktērijām. Neskatoties uz sasniegumiem infekciju kontroles pasākumos, piemēram, sterilizācijas metodēs, profilaktisko antibiotiku lietošanā un ķirurģiskās prakses uzlabojumos, SSI joprojām ir pastāvīga komplikācija.
Vienā nozīmīgā pārskatā ir pētīta HBOT efektivitāte dziļu SSI profilaksē neiromuskulāras skoliozes ķirurģijā. Preoperatīva HBOT var ievērojami samazināt SSI sastopamību un veicināt brūču dzīšanu. Šī neinvazīvā terapija rada vidi, kurā skābekļa līmenis brūces audos ir paaugstināts, kas ir saistīts ar oksidatīvo nogalināšanas darbību pret patogēniem. Turklāt tā novērš pazemināto asins un skābekļa līmeni, kas veicina SSI attīstību. Papildus citām infekcijas kontroles stratēģijām, HBOT ir īpaši ieteicams operācijām ar tīru, piesārņotu vidi, piemēram, kolorektālajām procedūrām.
1.4 Apdegumi
Apdegumi ir ievainojumi, ko izraisa ārkārtējs karstums, elektriskā strāva, ķīmiskas vielas vai starojums, un tie var izraisīt augstu saslimstības un mirstības līmeni. HBOT ir labvēlīgs apdegumu ārstēšanā, palielinot skābekļa līmeni bojātajos audos. Lai gan dzīvnieku un klīniskie pētījumi uzrāda dažādus rezultātus attiecībā uzHBOT efektivitāte apdegumu ārstēšanāPētījumā, kurā piedalījās 125 apdegumu pacienti, norādīts, ka HBOT neuzrādīja būtisku ietekmi uz mirstības rādītājiem vai veikto operāciju skaitu, bet samazināja vidējo dzīšanas laiku (19,7 dienas salīdzinājumā ar 43,8 dienām). HBOT integrēšana visaptverošā apdegumu aprūpē varētu efektīvi kontrolēt sepsi apdegumu pacientiem, tādējādi saīsinot dzīšanas laiku un samazinot šķidruma nepieciešamību. Tomēr ir nepieciešami turpmāki plaši perspektīvi pētījumi, lai apstiprinātu HBOT lomu plašu apdegumu ārstēšanā.
1.5 Osteomielīts
Osteomielīts ir kaulu vai kaulu smadzeņu infekcija, ko bieži izraisa baktēriju patogēni. Osteomielīta ārstēšana var būt sarežģīta, jo kauliem ir relatīvi slikta asinsapgāde un antibiotiku ierobežotā iekļūšana smadzenēs. Hronisku osteomielītu raksturo pastāvīgi patogēni, viegls iekaisums un nekrotiska kaulu audu veidošanās. Refraktārs osteomielīts attiecas uz hroniskām kaulu infekcijām, kas turpinās vai atkārtojas, neskatoties uz atbilstošu ārstēšanu.
Ir pierādīts, ka HBOT ievērojami uzlabo skābekļa līmeni inficētajos kaulu audos. Daudzas gadījumu sērijas un kohortas pētījumi liecina, ka HBOT uzlabo klīniskos rezultātus pacientiem ar osteomielītu. Šķiet, ka tas darbojas, izmantojot dažādus mehānismus, tostarp veicinot vielmaiņas aktivitāti, nomācot baktēriju patogēnus, pastiprinot antibiotiku iedarbību, mazinot iekaisumu un veicinot dzīšanu.procesi. Pēc HBOT 60–85 % pacientu ar hronisku, refraktāru osteomielītu novēro infekcijas nomākuma pazīmes.
1.6 Sēnīšu infekcijas
Visā pasaulē vairāk nekā trīs miljoni cilvēku cieš no hroniskām vai invazīvām sēnīšu infekcijām, kas katru gadu izraisa vairāk nekā 600 000 nāves gadījumu. Sēnīšu infekciju ārstēšanas rezultātus bieži vien pasliktina tādi faktori kā izmainīts imūnsistēmas statuss, pamatslimības un patogēnu virulences īpašības. HBOT kļūst par pievilcīgu terapeitisku iespēju smagu sēnīšu infekciju gadījumā, pateicoties tā drošībai un neinvazīvajam raksturam. Pētījumi liecina, ka HBOT varētu būt efektīvs pret sēnīšu patogēniem, piemēram, Aspergillus un Mycobacterium tuberculosis.
HBOT veicina pretsēnīšu iedarbību, kavējot Aspergillus bioplēves veidošanos, un paaugstināta efektivitāte ir novērota celmiem, kuriem trūkst superoksīda dismutāzes (SOD) gēnu. Hipoksiskie apstākļi sēnīšu infekciju laikā rada grūtības pretsēnīšu zāļu piegādei, padarot HBOT paaugstināto skābekļa līmeni par potenciāli labvēlīgu iejaukšanos, lai gan ir nepieciešami turpmāki pētījumi.
HBOT antimikrobiālās īpašības
HBOT radītā hiperoksiskā vide ierosina fizioloģiskas un bioķīmiskas izmaiņas, kas stimulē antibakteriālas īpašības, padarot to par efektīvu papildterapiju infekcijas ārstēšanā. HBOT demonstrē ievērojamu iedarbību pret aerobām baktērijām un galvenokārt anaerobām baktērijām, izmantojot tādus mehānismus kā tieša baktericīda aktivitāte, imūnās atbildes pastiprināšana un sinerģiska iedarbība ar specifiskiem pretmikrobu līdzekļiem.
2.1 HBOT tiešā antibakteriālā iedarbība
HBOT tiešā antibakteriālā iedarbība lielā mērā tiek attiecināta uz reaktīvo skābekļa sugu (ROS) veidošanos, kas ietver superoksīda anjonus, ūdeņraža peroksīdu, hidroksilradikāļus un hidroksiljonus, kas visi rodas šūnu metabolisma laikā.
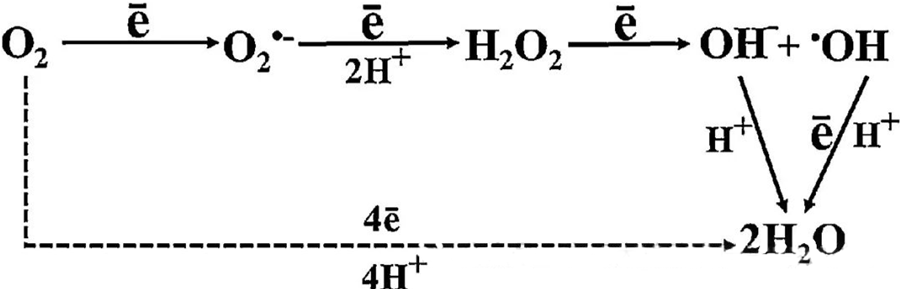
Mijiedarbība starp O₂ un šūnu komponentiem ir būtiska, lai izprastu, kā ROS veidojas šūnās. Noteiktos apstākļos, ko sauc par oksidatīvo stresu, tiek izjaukts līdzsvars starp ROS veidošanos un to noārdīšanos, kā rezultātā šūnās paaugstinās ROS līmenis. Superoksīda (O₂⁻) veidošanos katalizē superoksīda dismutāze, kas pēc tam pārvērš O₂⁻ par ūdeņraža peroksīdu (H₂O₂). Šo pārvēršanu vēl vairāk pastiprina Fentona reakcija, kas oksidē Fe²⁺, veidojot hidroksilradikāļus (·OH) un Fe³⁺, tādējādi uzsākot kaitīgu ROS veidošanās redoksa secību un šūnu bojājumus.
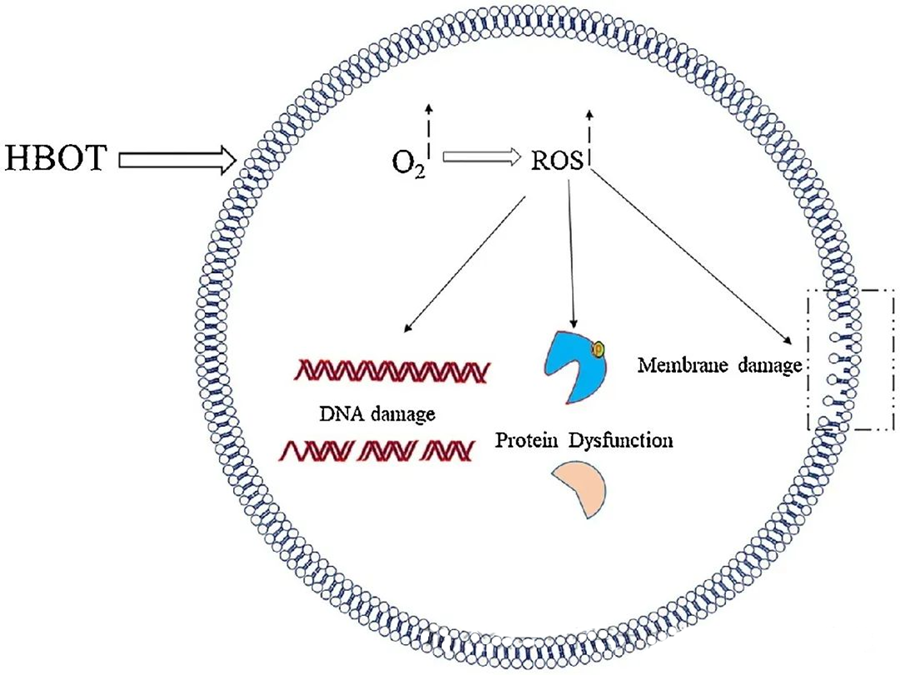
ROS toksiskā iedarbība ir vērsta uz kritiski svarīgiem šūnu komponentiem, piemēram, DNS, RNS, olbaltumvielām un lipīdiem. Jāatzīmē, ka DNS ir galvenais H₂O₂ mediētas citotoksicitātes mērķis, jo tā izjauc dezoksiribozes struktūras un bojā bāzes sastāvu. ROS izraisītie fizikālie bojājumi attiecas arī uz DNS spirāles struktūru, un tie, iespējams, rodas ROS izraisītas lipīdu peroksidācijas rezultātā. Tas uzsver paaugstināta ROS līmeņa nelabvēlīgās sekas bioloģiskajās sistēmās.
ROS pretmikrobu iedarbība
ROS ir būtiska loma mikrobu augšanas kavēšanā, kā to pierāda HBOT izraisīta ROS veidošanās. ROS toksiskā iedarbība tieši ietekmē šūnu sastāvdaļas, piemēram, DNS, olbaltumvielas un lipīdus. Augsta aktīvo skābekļa sugu koncentrācija var tieši bojāt lipīdus, izraisot lipīdu peroksidāciju. Šis process apdraud šūnu membrānu integritāti un līdz ar to arī ar membrānu saistīto receptoru un olbaltumvielu funkcionalitāti.
Turklāt olbaltumvielas, kas ir arī nozīmīgi ROS molekulārie mērķi, tiek pakļautas specifiskām oksidatīvām modifikācijām dažādās aminoskābju atliekās, piemēram, cisteīnā, metionīnā, tirozīnā, fenilalanīnā un triptofānā. Piemēram, ir pierādīts, ka HBOT izraisa oksidatīvas izmaiņas vairākās E. coli olbaltumvielās, tostarp elongācijas faktorā G un DnaK, tādējādi ietekmējot to šūnu funkcijas.
Imunitātes stiprināšana, izmantojot HBOT
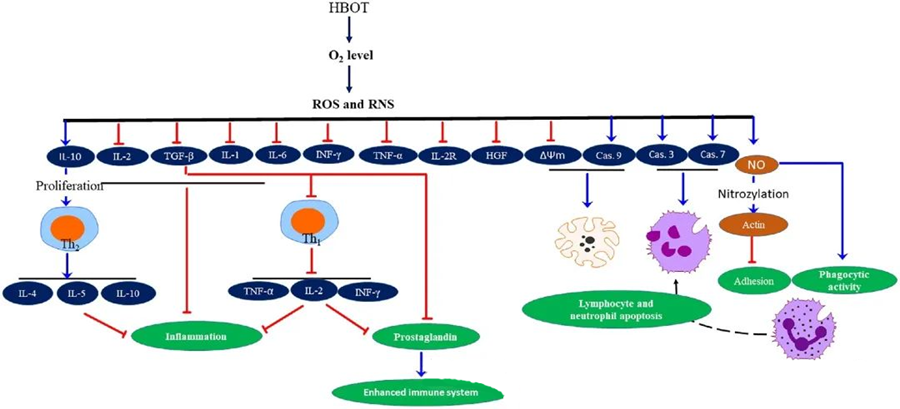
HBOT pretiekaisuma īpašībasir dokumentēti, un tie ir izrādījušies izšķiroši audu bojājumu mazināšanā un infekcijas progresēšanas nomākšanā. HBOT būtiski ietekmē citokīnu un citu iekaisuma regulatoru ekspresiju, ietekmējot imūnreakciju. Dažādās eksperimentālās sistēmās pēc HBOT tika novērotas atšķirīgas izmaiņas gēnu ekspresijā un olbaltumvielu veidošanā, kas vai nu palielina, vai samazina augšanas faktoru un citokīnu ekspresiju.
HBOT procesa laikā paaugstināts O₂ līmenis izraisa virkni šūnu reakciju, piemēram, nomācot iekaisumu veicinošu mediatoru izdalīšanos un veicinot limfocītu un neitrofilu apoptozi. Kopā šīs darbības pastiprina imūnsistēmas pretmikrobu mehānismus, tādējādi veicinot infekciju dzīšanu.
Turklāt pētījumi liecina, ka paaugstināts O₂ līmenis HBOT laikā var samazināt iekaisumu veicinošu citokīnu, tostarp gamma interferona (IFN-γ), interleikīna-1 (IL-1) un interleikīna-6 (IL-6), ekspresiju. Šīs izmaiņas ietver arī CD4:CD8 T šūnu attiecības samazināšanos un citu šķīstošo receptoru modulēšanu, galu galā paaugstinot interleikīna-10 (IL-10) līmeni, kas ir ļoti svarīgi iekaisuma novēršanai un dzīšanas veicināšanai.
HBOT antimikrobiālās aktivitātes ir savstarpēji saistītas ar sarežģītiem bioloģiskiem mehānismiem. Ir ziņots, ka gan superoksīds, gan paaugstināts spiediens nekonsekventi veicina HBOT izraisītu antibakteriālu aktivitāti un neitrofilu apoptozi. Pēc HBOT ievērojama skābekļa līmeņa paaugstināšanās pastiprina neitrofilu baktericīdās spējas, kas ir būtiska imūnās atbildes sastāvdaļa. Turklāt HBOT nomāc neitrofilu adhēziju, ko mediē β-integrīnu mijiedarbība uz neitrofiliem ar starpšūnu adhēzijas molekulām (ICAM) uz endotēlija šūnām. HBOT inhibē neitrofilu β-2 integrīna (Mac-1, CD11b/CD18) aktivitāti, izmantojot slāpekļa oksīda (NO) mediētu procesu, veicinot neitrofilu migrāciju uz infekcijas vietu.
Lai neitrofili efektīvi fagocitētu patogēnus, ir nepieciešama precīza citoskeleta pārkārtošanās. Ir pierādīts, ka aktīna S-nitrozilēšana stimulē aktīna polimerizāciju, potenciāli veicinot neitrofilu fagocītu aktivitāti pēc HBOT pirmapstrādes. Turklāt HBOT veicina apoptozi cilvēka T šūnu līnijās, izmantojot mitohondriju ceļus, un ir ziņots par paātrinātu limfocītu nāvi pēc HBOT. Kaspāzes-9 bloķēšana, neietekmējot kaspāzi-8, ir pierādījusi HBOT imūnmodulējošo iedarbību.
HBOT sinerģiskā iedarbība ar pretmikrobu līdzekļiem
Klīniskajos pielietojumos HBOT bieži lieto kopā ar antibiotikām, lai efektīvi apkarotu infekcijas. HBOT laikā sasniegtais hiperoksisks stāvoklis var ietekmēt noteiktu antibiotiku līdzekļu efektivitāti. Pētījumi liecina, ka specifiskas baktericīdas zāles, piemēram, β-laktāmi, fluorhinoloni un aminoglikozīdi, darbojas ne tikai ar raksturīgiem mehānismiem, bet arī daļēji balstās uz baktēriju aerobo metabolismu. Tāpēc skābekļa klātbūtne un patogēnu metabolisma īpašības ir izšķirošas, novērtējot antibiotiku terapeitisko iedarbību.
Nozīmīgi pierādījumi liecina, ka zems skābekļa līmenis var palielināt Pseudomonas aeruginosa rezistenci pret piperacilīnu/tazobaktāmu un ka zema skābekļa vide arī veicina Enterobacter cloacae paaugstinātu rezistenci pret azitromicīnu. Turpretī noteikti hipoksiski apstākļi var palielināt baktēriju jutību pret tetraciklīna antibiotikām. HBOT kalpo kā dzīvotspējīga papildterapijas metode, inducējot aerobo metabolismu un reoksigenējot hipoksiski inficētos audus, pēc tam palielinot patogēnu jutību pret antibiotikām.
Preklīniskajos pētījumos HBOT kombinācija — ievadīta divas reizes dienā 8 stundas pie 280 kPa — kopā ar tobramicīnu (20 mg/kg/dienā) ievērojami samazināja baktēriju daudzumu Staphylococcus aureus infekciozā endokardīta gadījumā. Tas parāda HBOT potenciālu kā palīgterapiju. Turpmākie pētījumi atklāja, ka 37°C temperatūrā un 3 ATA spiedienā 5 stundas HBOT ievērojami pastiprināja imipenēma iedarbību pret makrofāgu inficēto Pseudomonas aeruginosa. Turklāt tika konstatēts, ka HBOT kombinētā lietošana ar cefazolīnu ir efektīvāka Staphylococcus aureus osteomielīta ārstēšanā dzīvnieku modeļos, salīdzinot ar cefazolīnu vienu pašu.
HBOT arī ievērojami palielina ciprofloksacīna baktericīdo iedarbību pret Pseudomonas aeruginosa bioplēvēm, īpaši pēc 90 minūšu iedarbības. Šis uzlabojums tiek attiecināts uz endogēno reaktīvo skābekļa sugu (ROS) veidošanos un uzrāda paaugstinātu jutību mutantos ar peroksidāzes defektiem.
Meticilīnrezistenta Staphylococcus aureus (MRSA) izraisīta pleirīta modeļos vankomicīna, teikoplanīna un linezolīda kopīgā iedarbība ar HBOT uzrādīja ievērojami palielinātu efektivitāti pret MRSA. Metronidazols, antibiotika, ko plaši lieto smagu anaerobu un polimikrobiālu infekciju, piemēram, diabētiskās pēdas infekciju (DFI) un ķirurģisko vietu infekciju (SSI), ārstēšanā, ir uzrādījusi augstāku pretmikrobu efektivitāti anaerobos apstākļos. Ir nepieciešami turpmāki pētījumi, lai izpētītu HBOT sinerģisko antibakteriālo iedarbību kombinācijā ar metronidazolu gan in vivo, gan in vitro apstākļos.
HBOT antimikrobiālā iedarbība pret rezistentām baktērijām
Līdz ar rezistentu celmu evolūciju un izplatīšanos tradicionālās antibiotikas laika gaitā bieži zaudē savu iedarbību. Turklāt HBOT var izrādīties būtiska multirezistentu patogēnu izraisītu infekciju ārstēšanā un profilaksē, kalpojot par kritisku stratēģiju, ja antibiotiku terapija neizdodas. Daudzos pētījumos ir ziņots par HBOT ievērojamo baktericīdo iedarbību uz klīniski nozīmīgām rezistentām baktērijām. Piemēram, 90 minūšu HBOT sesija ar 2 atmosfēras ātrumu ievērojami samazināja MRSA augšanu. Turklāt attiecību modeļos HBOT ir uzlabojis dažādu antibiotiku antibakteriālo iedarbību pret MRSA infekcijām. Ziņojumi ir apstiprinājuši, ka HBOT ir efektīvs OXA-48 producējošas Klebsiella pneumoniae izraisīta osteomielīta ārstēšanā, neizmantojot papildu antibiotikas.
Rezumējot, hiperbariskā skābekļa terapija ir daudzpusīga pieeja infekcijas kontrolei, uzlabojot imūnreakciju, vienlaikus pastiprinot arī esošo pretmikrobu līdzekļu efektivitāti. Pateicoties visaptverošiem pētījumiem un attīstībai, tai ir potenciāls mazināt antibiotiku rezistences ietekmi, sniedzot cerību notiekošajā cīņā pret bakteriālām infekcijām.
Publicēšanas laiks: 2025. gada 28. februāris

